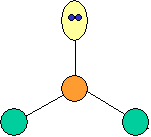
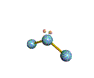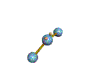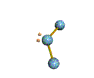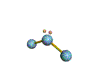Règles et notations VSEPR
AXmEn ; où A est l'atome central de
la molécule, X représente les paires liantes (simples, doubles ou triples
liaisons), E les paires non liantes (doublets non liants) et m,n représentent
le nombre de paires de chaque type.
Règle
n°1 :
Il faut minimaliser la répulsion entre les paires électroniques (libres et
liantes). Celles-ci se répartissent l'espace disponible (3D !).
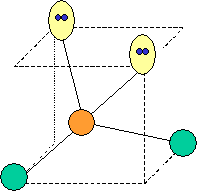
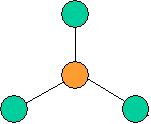
· cas de 2 paires électroniques : AX2E0
![]()
2 paires opposées au maximum (180°) La
molécule est linéaire et l'angle entre les deux paires est un angle plat (180°)
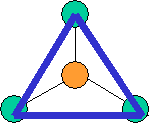
· cas de 3 paires électroniques : AX3E0
 *
*
*(c)
Animated gif : Robyn Rindge '98 | www.chimmybear.com
3 paires situées dans le même plan et à
égale distance les unes des autres : 120°, La molécule a la forme d'un triangle
plan
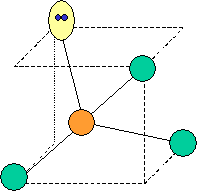
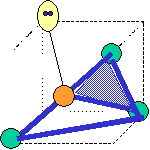
· cas de 4 paires électroniques : AX4E0
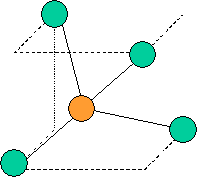
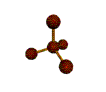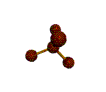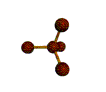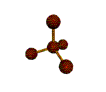
4 paires liantes dirigées vers le centre
d'un tétraèdre régulier et situées à 109° les unes des autres. La molécule est
de forme tétraédrique.
Avec doublets non liants
Règle
n°2 :
Les paires libres occupent plus de place que les paires liantes car la
répulsion des paires libres est plus forte. Les angles entre les paires seront
différents. De plus si les différents endroits ne sont pas équidistants, les
paires libres se placeront préférentiellement le plus loin.
· cas de 3 paires électroniques :
|
AX3E0 |
AX2E1 |
||
|
|
|
||
|
forme
de la molécule : |
|||
|
|
|
||
|
triangle plan |
coudée |
||
|
BF3 |
O3 |
||
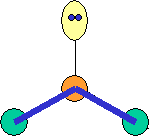
· cas de 4 paires électroniques :
|
AX4E0 |
AX3E1 |
AX2E2 |
|
|
|
|
|
|
|
|
|
forme
de la molécule : |
||
|
|
|
|
|
tétraèdre |
pyramide
à base triangulaire |
coudée |
|
CH4 |
NH3 |
H2O |